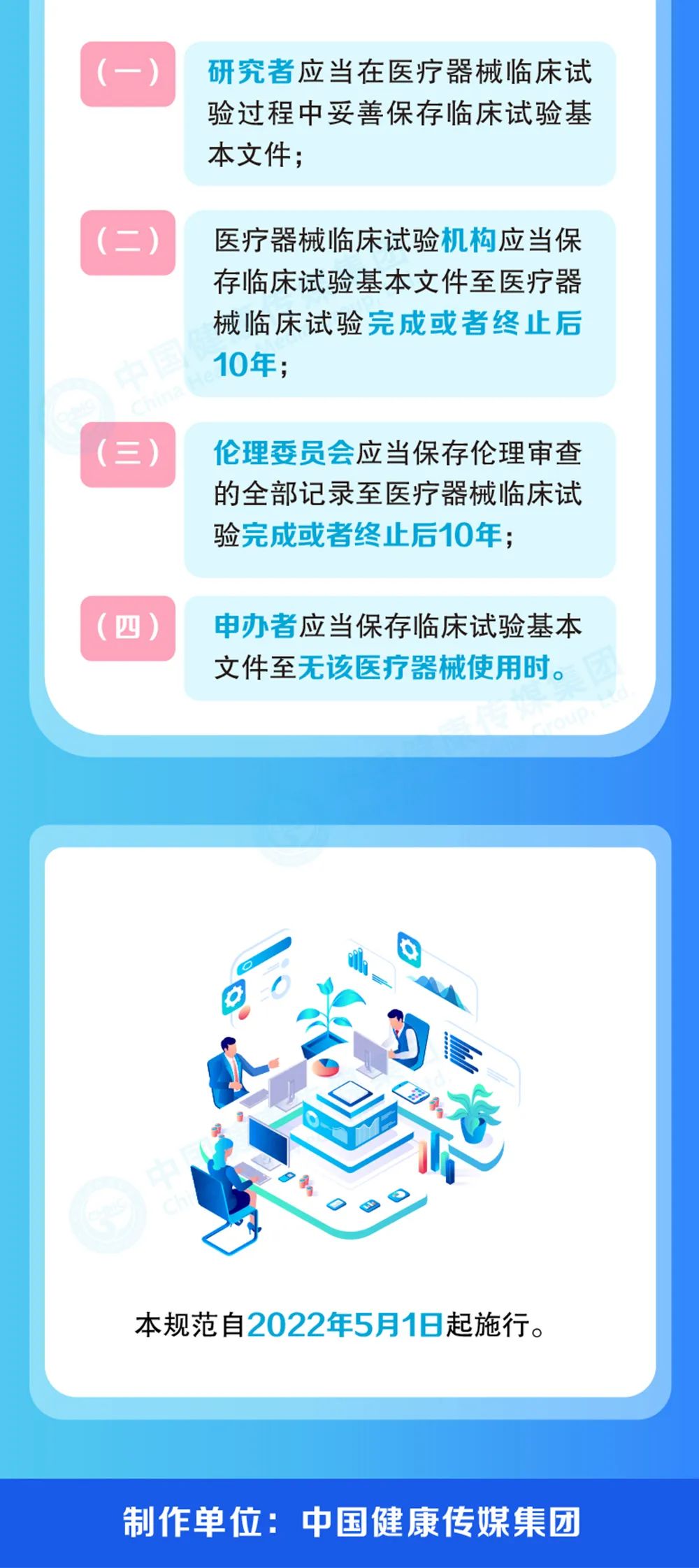
根据 《医疗器械监督管理条例》,制定本规范。在中华人民共和国境内,为申请医疗器械(含体外诊断试剂,下同)注册而实施的医疗器械临床试验相关活动,应当遵守本规范。本规范涵盖医疗器械临床试验全过程,包括医疗器械临床试验的方案设计、实施、监查、稽查、检查以及数据的采集、记录、保存、分析,总结和报告等。
医疗器械临床试验应当在具备相应条件并且按照规定备亲的医疗器械临床试验机构实施。医疗器械临床试验的申办者应当建立覆盖医疗器械临床试验全过程的质量管理体系确保医疗噐械临床试验符合相关法律法规,保护受试者权益和安全。